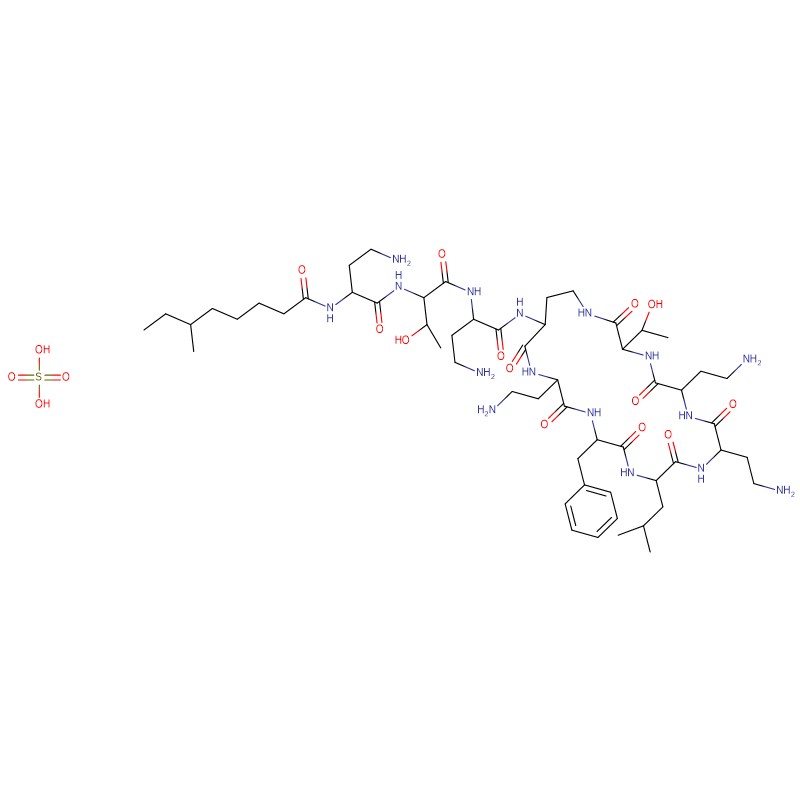
Polymyxin B sulfate CAS: 1405-20-5 Wäiss Pudder
| Katalognummer | XD90360 |
| Produit Numm | Polymyxin B Sulfat |
| CAS | 1405-20-5 |
| Molekulare Formel | C55H96N16O13 · 2H2SO4 |
| Molekulare Gewiicht | 1385.61 |
| Stockage Detailer | 2 bis 8°C |
| Harmoniséierten Tarifcode | 29419000 |
Produit Spezifizéierung
| Conclusioun | Entsprécht USP35 |
| Heavy Metal | <20 ppm |
| pH | 5-7 |
| Identifikatioun | Flëssegchromatographie: entsprécht |
| Assay | 99% |
| Ausgesinn | Wäiss Pudder |
| Verloscht op dréchen | <6% |
| Solubilitéit | Fräi löslech am Waasser, liicht löslech am Ethanol |
| Sulfat | 15,5% - 17,5% |
| Partikelgréisst | <30 µm |
| Spezifesch optesch Rotatioun | -78° -90° |
| Phenylalanin | 9,0% -12,0% |
| Pyrogenen | Entsprécht den Ufuerderunge |
| Sulfatéiert Asche | <0.75% |
| Total liewensfäeg aerobic Zuel | <100 cfu/g |
| Potenz | >6500 IU/mg |
D'ExPortal Proteinsekretiounsorganelle am Streptococcus pyogenes ass en anionescht Phospholipid-haltege Membran-Mikrodomain beräichert an Sec-Translokonen a Postsekretiouns-Protein-Biogenesefaktoren.Polymyxin B bindt sech un a stéiert d'ExPortal Integritéit, wat zu enger defekter Sekretioun vu verschiddenen Toxine resultéiert.Fir Abléck an Faktoren ze kréien, déi d'ExPortal Organisatioun beaflossen, gouf e geneteschen Écran duerchgefouert fir spontan Polymyxin B-resistente Mutanten ze wielen déi verstäerkt ExPortal Integritéit weisen.Ganz-Genom Resequencing vu 25 resistente Mutanten huet vun enger bis véier Mutatiounen pro mutant Genom opgedeckt, haaptsächlech an engem Kärset vun 10 Gengruppen geclustert.Konstruktioun vu Mutanten mat individuellen Läschen oder Insertiounen huet bewisen datt 7 Kärgenen Resistenz a verstäerkter ExPortal Integritéit duerch Funktiounsverloscht vermëttelen, während 3 méiglecherweis wéinst Funktiounsgewënn an /oder kombinatoreschen Effekter waren.Core Resistenz Genen enthalen en transkriptionalen Reguléierer vu Lipidbiosynthese, verschidde Genen, déi an der Nährstoffacquisitioun involvéiert sinn, a verschidde Genen, déi u Stressreaktiounen involvéiert sinn.Zwee Membere vun der leschter Klass funktionnéieren och als neie Reguléierer vun der secretéierter SpeB Cysteinprotease.Analyse vun der heefegst isoléierter Mutatioun, eng eenzeg Nukleotid-Läschung an enger Streck vun 9 konsekutiven Adeninreschter am pstS, kodéiert e Bestanddeel vun engem Pi-Transporter mat héijer Affinitéit, suggeréiert datt dës Sequenz als molekulare Schalter funktionnéiert fir Stressadaptatioun ze erliichteren.Zesummen suggeréieren dës Donnéeën d'Existenz vun enger Membranstressreaktioun déi verstäerkt ExPortal Integritéit a Resistenz géint kationesch antimikrobial Peptiden fördert.