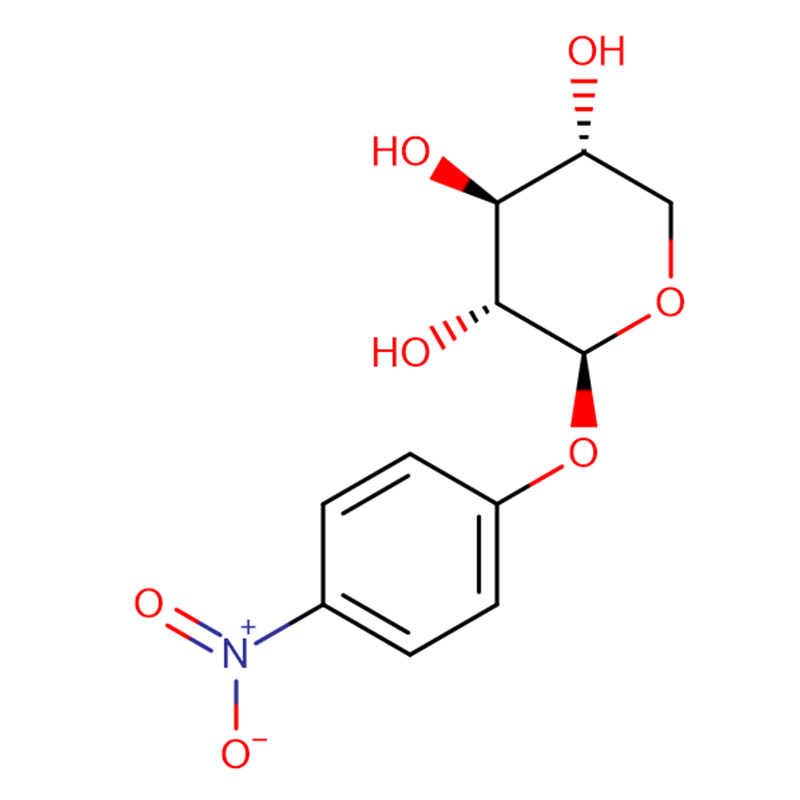
D'Biosynthese vu Proteoglycanen a Glycosaminoglycanen an der Präsenz vu p-nitrophenyl-xyloside gouf studéiert mat Hëllef vun engem primäre Ratten ovarian granulosa Zellkultursystem.D'Additioun vu p-nitrophenyl-xyloside an Zellkulturmedium verursaacht ongeféier eng 700% Erhéijung vun der [35S]-Sulfat-Inkorporatioun (ED50 bei 0.03 mM) an Makromolekülen, déi gratis Chondroitin-Sulfat-Ketten abegraff hunn, déi op Xyloside an gebierteg Proteoglykanen initiéiert goufen.Gratis Chondroitin-Sulfatketten, déi op Xyloside initiéiert goufen, goufen bal ausschliesslech an d'Mëttel secretéiert.D'molekulare Gréisst vun de Chondroitin-Sulfatketten ass vu 40.000 op 21.000 erofgaang wéi d'total [35S]-Sulfat-Inkorporatioun verstäerkt gouf, wat suggeréiert datt eng verstäerkte Synthese vu Chondroitin-Sulfat den normale Mechanismus vun der Glycosaminoglycan-Ketteterminatioun gestéiert huet.Biosynthese vun Heparan-Sulfat-Proteoglycanen gouf ëm ongeféier 50% reduzéiert, wahrscheinlech wéinst der Konkurrenz um Niveau vun UDP-Zocker-Virgänger.[35S] Sulfat-Inkorporatioun gouf ofgeschloss duerch d'Zousatz vum Cyloheximid mat enger initialer Hallefzäit vun ongeféier 2 Stonnen an der Präsenz vu Xyloside, während dat an der Verontreiung vu Xyloside ongeféier 20 min.Den Ënnerscheed reflektéiert méiglecherweis den Ëmsaz vun der Glycosaminoglycan Synthetiséierungskapazitéit als Ganzt.Den Ëmsazquote vun der Glycosaminoglycan Synthetiséierungskapazitéit observéiert an Ovarial Granulosa Zellen war vill méi kuerz wéi déi an Chondrocyten observéiert, wat d'relativ Dominanz vun der proteoglycan biosynthetescher Aktivitéit an der totaler metabolescher Aktivitéit vun den Zellen reflektéiert.